2023-12-13
2023 ASH 口头|恒瑞引进创新药林普利塞治疗复发和/或难治性外周T细胞淋巴瘤II期临床研究结果公布
12月9日至12日,第65届美国血液学会(ASH)年会在美国圣迭戈举行,作为全球血液学领域最大最全面的国际盛会之一,ASH年会议题涵盖恶性与非恶性血液疾病,每年都会吸引来自全球100多个国家的25000余名血液学家和其他相关医疗保健专业人士参会,分享最前沿的血液学进展和突破性临床数据。其中,由北京大学肿瘤医院淋巴瘤科团队牵头开展的“林普利塞治疗R/R外周T/NK细胞淋巴瘤的多中心II期临床研究”入选本次ASH大会口头报告环节1。

林普利塞治疗R/R 外周T/NK细胞淋巴瘤的多中心II期临床研究入选2023 ASH大会口头报告
研究背景
外周T细胞淋巴瘤(PTCL)是一种异质性强、侵袭性高的非霍奇金淋巴瘤(NHL),复发和/或难治性(R/R)PTCL的治疗选择有限,中位无进展生存期(mPFS)仅3-4个月。由于在T、B和骨髓细胞肿瘤微环境中的多种细胞活性,PI3Kδ抑制剂已在T细胞和B细胞淋巴瘤中显示出临床活性。然而,这些药物的应用受到耐受性差的阻碍,特别是毒性,比如腹泻/结肠炎、肝毒性、肺炎、高血糖症和皮疹。
林普利塞作为一种新型的高选择性PI3Kδ抑制剂,在R/R滤泡性淋巴瘤(FL)和PTCL的I期和II期临床试验中显示出有效性和良好的安全性。林普利塞于2022年在中国获得上市批准,用于既往接受过2种全身治疗的R/R FL患者。本次报道了林普利塞在R/R PTCL关键2期试验中的疗效和安全性结果。
研究设计
这是一项开放标签、2期注册研究(NCTO4705090),2021年5月至2022年10月,中国25家研究中心共入组98例患者。关键入选标准:1)年龄≥18岁,男女不限;2)经病理证实的PTCL,包括但不限于:PTCL非特指型(PTCL-NOS)、血管免疫母细胞性T细胞淋巴瘤(AITL)、ALK阳性或阴性间变性大细胞淋巴瘤(ALCL)、NK/T细胞淋巴瘤(NKTCL)、肝脾T细胞淋巴瘤(HSTCL)、肠病相关T细胞淋巴瘤(EATL)等;3)经过至少一次PTCL全身系统性治疗失败或不能耐受的PTCL全身治疗;4)对于复发难治性ALCL,需要包括抗CD30单克隆抗体(BV)在内的既往治疗,NKTCL以门冬酰胺酶为基础的方案治疗;5)ECOG评分0-1;6)至少有一个可测量的靶病灶(Lugano2014标准);7)充足的器官功能。林普利塞以80 mg QD(RP2D)连续口服给药,直至疾病进展、不可耐受的毒性或退出研究。
主要终点为客观缓解率ORR(独立审查委员会根据Lugano2014标准评估),次要终点为缓解持续时间(DoR),无进展生存期(PFS),总生存期(OS),疾病控制率(DCR),至缓解时间(TTR)及安全性。

图1. 研究设计
研究结果
1. 患者基线特征
在这项II期研究中,中位年龄为57岁(25-82岁),ECOG 0-1(100%)。大多数患者为Lugano 2014 III期(29例,33%)或IV期(49例,56%)。既往系统性治疗的中位线数为2,73%的患者为末线难治。安全分析集(SAS)纳入98例患者,88例可评估疗效的患者被纳入全分析集(FAS)。
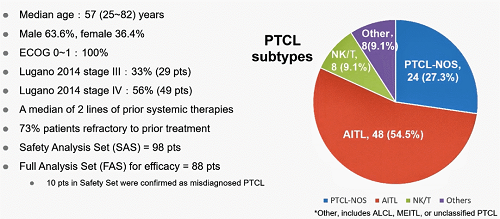
图2.患者基线情况
2. 临床疗效
本研究达到了主要终点,FAS集的总缓解率(ORR)为48%,26例患者(30%)达到完全缓解(CR),16例患者(18%)部分缓解(PR),还有18例患者(20%)达到疾病稳定(SD),疾病控制率(DCR)为68%。
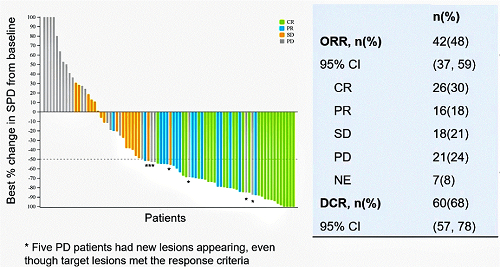
图3. 临床疗效
首次评估的中位TTR为1.9个月(范围:1.7-3.8个月),6个月DoR为75%,中位DoR未达到(95% CI:7.8-NR)。
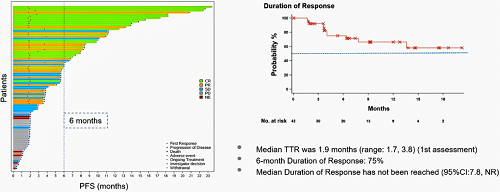
图4. DoR
在PTCL各亚型中,AITL、PTCL-NOS、NK/T患者ORR分别为65%、29%、25%,在AITL、PTCL-NOS、NK/T患者中DCR分别为81%、58%、63%。
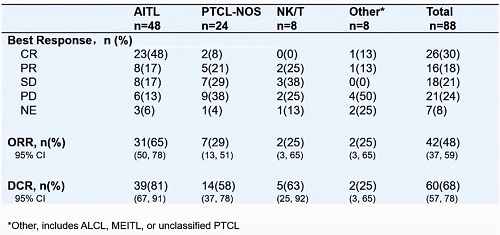
表1. PTCL各亚型疗效
截至2023年4月24日,中位随访14.8个月时,中位PFS为5.5个月(95% CI: 3.5-15.6),6个月总生存(OS)率为75%(95% CI: 64.51%-82.74%),中位OS为14.2个月(95% CI: 7.9-NR)。中位DoR未达到(95% CI:7.8-NR)。
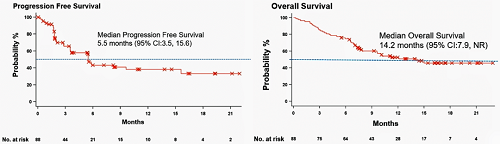
图5. PFS(左)和OS(右)
总结
在这项R/R PTCL II期研究中,林普利塞单药治疗的ORR达到48% (30% CR),达到主要终点。并且在PTCL各亚型中均观察到缓解。研究结果表明,林普利塞单药治疗R/R外周T/NK细胞淋巴瘤获得了较高的缓解率2,且具有良好的耐受性和安全性。基于该研究结果,林普利塞新适应症上市申请获国家药品监督管理局(NMPA)受理,用于治疗R/R PTCL患者。
作为创新型国际化制药企业,恒瑞医药多年来深入践行“科技为本、为人类创造健康生活”的使命,已在国内获批上市13款自研1类创新药、1款自研2类新药及2款合作引进创新药,其中抗肿瘤创新药达9款。目前,在抗肿瘤领域,公司共有51款创新产品在研。
未来,恒瑞医药将继续坚持“以患者为中心”的理念,不断强化创新主体地位,努力研制生产出更多新药、好药,服务健康中国,造福全球患者。
声明:本文仅为展示医学研究最新进展,不代表对于治疗方法和药品的推荐,相关药品的使用请咨询专业医师。参考文献:
1.Yuqin Song,et,al. A Multicenter Phase2 Trial of Linperlisib in Relapsed or Refractory Peripheral T/NK Cell Lymphomas.2023 ASH. Abstract 306
2.非头对头比较