2023-08-01
恒瑞医药创新药吡咯替尼肺癌研究成果登上《自然医学》
近日,恒瑞医药创新药吡咯替尼(艾瑞妮®)一线治疗HER2突变非小细胞肺癌(NSCLC):一项以患者为中心的Ⅱ期临床试验的研究结果发表于国际顶级学术期刊《自然》子刊《自然医学》(Nature Medicine)(IF=82.9),该研究由广东省人民医院广东省肺癌研究所吴一龙教授团队牵头开展,公布了大型伞式研究(CTONG1702)的第7个臂组(HER2-arm)的结果与同期开展的观察性真实世界研究(CTONG 1705)的部分结果[1]。
该研究首次提出了一种对于罕见基因变异患者的全新临床试验模式,此次文章发表报道了HER2突变型晚期NSCLC初治患者接受吡咯替尼及临床常规治疗,在严格入组队列、同情给药队列和真实世界队列中,客观缓解率(ORR)分别为35.7%、16.7%和0%,中位无进展生存期(PFS)分别为7.3个月、4.7个月和3.0个月[1]。

"吡咯替尼一线治疗HER2 NSCLC:一项以患者为中心的Ⅱ期临床试验"发表于《Nature Medicine》
研究背景与设计
为扩大患者的可及性,同时进一步了解在更广泛人群中获益-风险概况,本研究建立了两个队列。对符合临床试验严格入组标准的患者纳入严格入组(Criteria-Fulfilled, CF)队列;如患者不符合入排标准,如存在活动性乙肝或丙肝等,可入组同情给药(Compassionate Use,CU)队列。CF和CU队列患者接受吡咯替尼治疗。对于拒绝参加临床试验或拒绝遵守试验的定期随访要求的患者,进入观察性真实世界研究CTONG1705(真实世界队列),接受临床常规治疗。
HER2突变在肺癌中的发生率为2%-4%[2],目前尚未有获批的一线靶向药物。吡咯替尼是恒瑞医药自主研发并拥有知识产权的口服HER1、HER2、HER4酪氨酸激酶抑制剂(TKI),是中国首个自主研发的抗HER1/HER2/HER4靶向药。继2018年8月获得有条件批准上市后,于2020年7月获得国家药品监督管理局完全批准,2019年纳入国家医保目录,用于联合卡培他滨治疗HER2阳性、接受过曲妥珠单抗治疗的复发或转移性乳腺癌患者。2022年和2023年分别获批第二个适应症和第三个适应症,为乳腺癌患者提供治疗新选择。
在2018年7月12日至2021年10月1日期间,使用二代基因测序(NGS)筛选了932名未经治疗的晚期NSCLC患者,共有48例(5.2%)HER2突变型晚期初治NSCLC患者,28例纳入CF队列、12例纳入CU队列,8例纳入真实世界研究(RWS)队列(图1)。
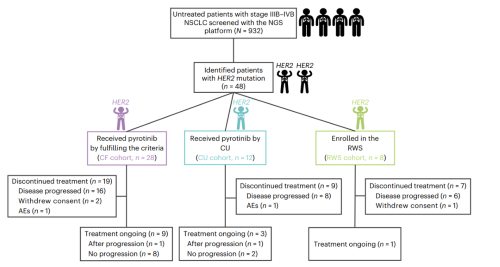
图1. 患者流程图
研究结果
疗效
CF队列(n=28)中位随访时间17.7个月,研究者评估确认的ORR为35.7%(95%CI: 18.0-53.5),达到了本研究预设的主要研究终点。大多数患者显示疾病控制及肿瘤缩小(图2),疾病控制率(DCR)为89.3%,中位PFS为7.3个月(图3a),中位总生存期(OS)为14.3个月(图3b)。
CU队列(n=12)中位随访时间17.7个月,ORR为16.7%(95%CI: 2.1-48.4),DCR为83.4%,中位PFS为4.7个月(图3a),中位OS为14.2个月(图3b)。
RWS队列(n=8)中位随访时间12.2个月,8例患者接受一线抗肿瘤治疗(化疗,n=2;免疫治疗,n=4;靶向治疗,n=2),均未达到完全和部分缓解,DCR为75.0%,中位PFS为3.0个月(图3a),中位OS为12.2个月(图3b)。
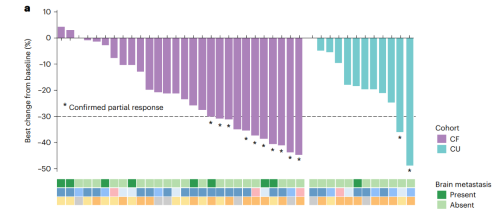
图2. 接受吡咯替尼治疗的HER2突变患者的肿瘤缓解瀑布图
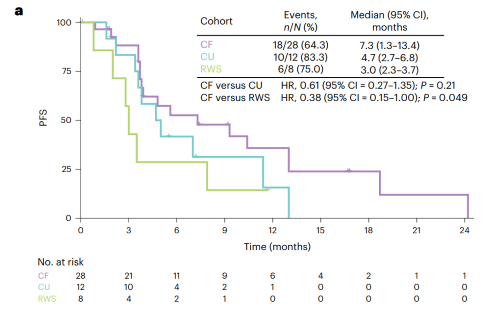
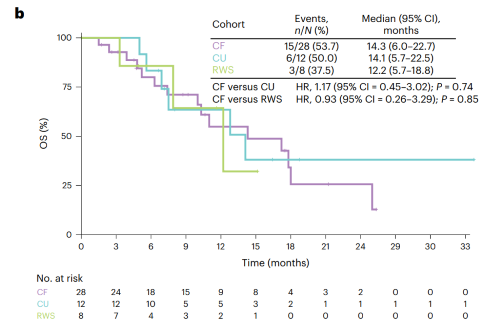
图3. CF队列、CU队列和真实世界队列的Kaplan-Meier生存曲线(a: PFS,b:OS)
吡咯替尼疗效亚组分析:
在不同的亚组中,包括脑转移和不同HER2突变亚型,均观察到吡咯替尼的疗效。有或无脑转移的患者使用吡咯替尼的临床获益相似(ORR:33.3% vs. 29.0%;中位PFS:7.0 vs. 5.6个月)。
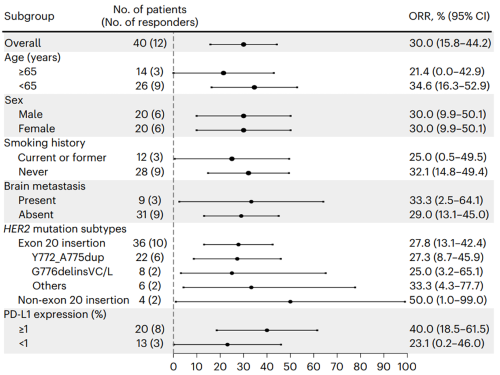
图4. 吡咯替尼疗效ORR亚组分析
总结
美国食品药品监督管理局(FDA)和国家药品监督管理局(NMPA)分别于2020年和2022年发布了关于“以患者为中心临床试验”指导原则。而吴一龙教授团队早在2018年便开创性启动了一项以患者为中心的Ⅱ期大型伞式研究(CTONG1702)并同期启动一项观察性真实世界研究(CTONG 1705),先于NMPA指导原则发布整整提前了5年布局“以患者为中心”的临床试验,理念超前,开创了先河。
本研究首次报道了吡咯替尼在未经治疗的HER2突变型NSCLC患者中的疗效和安全性。CF队列数据表明吡咯替尼的一线治疗HER2突变患者的疗效超越现有一线治疗;CU队列数据表明临床试验常规排除的患者也可从吡咯替尼治疗中获益。在药物安全性方面,正如预期的一样,CF队列≥3级的严重不良事件较少。但本研究有一定的局限性,由于HER2突变在NSCLC中的发生率较低,在研究期间纳入RWS队列的患者数量较少,因此RWS队列的研究结果可能不能完全代表现实世界的情况。
本研究显示吡咯替尼一线治疗HER2突变晚期NSCLC初治患者具有临床获益且安全可耐受。在严格入组队列的ORR达到35.7%,PFS为7.3个月。进一步证实了吡咯替尼是HER2突变的NSCLC初治患者的可选治疗方案。
《健康中国行动(2019-2030年)》提出,到2030年总体癌症五年生存率不低于46.6%。抗肿瘤药物是癌症患者控制和治疗疾病的重要希望。作为一家创新型国际化制药企业,恒瑞医药多年来针对中国高发肿瘤领域持续展开技术攻关,在中国获批上市自研创新药13款、引进创新药2款,其中肿瘤创新药达9款。未来,恒瑞医药将继续坚持“以患者为中心”的理念,重创新,强研发,力争研制出更多更好的新药,服务健康中国,惠及全球患者。
参考文献:
1.Si-Yang Maggie Liu, et al. First-line pyrotinib in advanced HER2-mutant non-small-cell lung cancer: a patient-centric phase 2 trial . Nat Med. 2023; doi: 10.1038/s41591-023-02461-x.
2.Stephens, P. et al. Lung cancer: intragenic ERBB2 kinase mutations in tumours. Nature 431, 525–526 (2004).