2021-10-06
恒瑞卡瑞利珠单抗联合阿帕替尼最新研究成果荣登《柳叶刀·肿瘤》
北京时间10月6日,全球顶尖学术期刊《柳叶刀·肿瘤》(The Lancet Oncology)全文在线发表“卡瑞利珠单抗联合阿帕替尼治疗高危型化疗耐药或复发妊娠滋养细胞肿瘤的单臂开放II期临床试验(CAP 01)”的研究成果1。

该研究由北京协和医院妇科肿瘤中心向阳教授发起,由恒瑞医药上市后医学团队支持完成,是迄今为止首个且样本量最大的程序性死亡受体1(PD-1)抑制剂联合血管内皮生长因子受体抑制剂治疗妊娠滋养细胞肿瘤的前瞻性研究。
卡瑞利珠单抗联合阿帕替尼展现出了很好的抗肿瘤活性,药物毒性可耐受,可作为高危型化疗耐药或复发妊娠滋养细胞肿瘤患者的一种挽救治疗方案。为卡瑞利珠单抗联合阿帕替尼在中国妊娠滋养细胞肿瘤患者中的临床应用提供了坚实的证据。
该研究自2019年8月7日至2020年3月18日共入组20例既往接受过至少二线多药化疗高危型化疗耐药或复发的妊娠滋养细胞肿瘤患者,其中19例为绒毛膜癌,1例为胎盘部位滋养细胞肿瘤患者。采用卡瑞利珠单抗(200 mg,每2周一次)联合阿帕替尼(250 mg,每日一次)治疗,直至肿瘤进展或不可耐受毒性。主要终点为根据血清人绒毛膜促性腺激素(hCG)水平评估的客观缓解率(ORR)。
研究显示,ORR为55% (95% CI 32%–77%),10例(50%;95% CI 27%–73%)患者达到完全缓解,1例(5%)为部分缓解。中位随访时间为18.5个月(IQR 14.6–20.9),中位无进展生存期(PFS)为9.5个月。中位总生存期(OS)未达到,12个月OS率为90%。
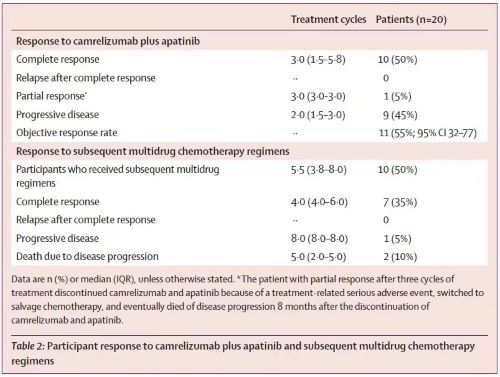
图示为肿瘤应答情况
从安全性来看,卡瑞利珠单抗联合阿帕替尼方案安全可耐受,最常见的3级治疗相关不良事件为高血压(5例,25%)、皮疹(4例,20%)、中性粒细胞计数减少(2例,10%)、白细胞计数减少(2例,10%)和天冬氨酸转氨酶升高(2例,10%)。一例患者发生了治疗相关严重不良事件(天冬氨酸转氨酶高于正常上限19倍)导致住院。没有4级或5级治疗相关不良事件发生。
既往针对高危型化疗耐药或复发妊娠滋养细胞肿瘤患者,仅有帕博利珠单抗的小样本结果(4例)2,而该证据的出现将免疫治疗引入了滋养细胞肿瘤NCCN指南。本CAP 01研究通过20例患者的数据为卡瑞利珠单抗联合阿帕替尼在中国高危型化疗耐药或复发妊娠滋养细胞肿瘤患者中的临床应用提供了坚实的证据,为其挽救治疗提供了新方向。未来卡瑞利珠单抗联合化疗以及前线使用卡瑞利珠单抗和阿帕替尼会在高危型妊娠滋养细胞肿瘤患者中进一步探索。
关于妊娠滋养细胞肿瘤
妊娠滋养细胞肿瘤是由胎盘滋养细胞异常增殖引起的,包括绒毛膜癌、胎盘部位滋养细胞肿瘤和上皮样滋养细胞瘤3。国际妇产科联盟(FIGO)于2000年审定并通过的预后评分标准将妊娠滋养细胞肿瘤患者分为低危型(FIGO评分<7)和高危型(FIGO评分≥7)4。低危型妊娠滋养细胞肿瘤患者多采用单药化疗,高危型患者多采用多药化疗方案3、5。尽管超过90%的高危型患者可通过初次治疗(如EMA/CO[依托泊苷、甲氨蝶呤和放线菌素D/环磷酰胺和长春新碱]、EMA/EP[依托泊苷、甲氨蝶呤和放线菌素D/依托泊苷和顺铂]和FAEV [氟脲苷、放线菌素D、依托泊苷和长春新碱]3、5、6)获得完全缓解,但仍有约5%的高危型患者发展为化疗耐药或多次复发并因疾病进展死亡6-8。对于高危型化疗耐药或复发的妊娠滋养细胞肿瘤患者急需探索新的治疗方法,特别是对那些经过多线化疗失败可能面临无药可用的患者。免疫治疗的应用或许能为此类患者带来新的希望!
参考文献:
1. Cheng H, Zong L, Kong Y, et al. Camrelizumab plus apatinib in patients with high-risk chemorefractory or relapsed gestational trophoblastic neoplasia (CAP 01): a single-arm, open-label, phase 2 trial. Lancet Oncol 2021. Published online first.
2. Ghorani E, Kaur B, Fisher RA, et al. Pembrolizumab is effective for drug-resistant gestational trophoblastic neoplasia. Lancet 2017; 390(10110): 2343.
3. Ngan HYS, Seckl MJ, Berkowitz RS, et al. Update on the diagnosis and management of gestational trophoblastic disease. Int J Gynaecol Obstet 2018; 143 Suppl 2: 79-85.
4. Kohorn EI. The new FIGO 2000 staging and risk factor scoring system for gestational trophoblastic disease: description and critical assessment. Int J Gynecol Cancer 2001; 11(1): 73-7.
5. Abu-Rustum NR, Yashar CM, Bean S, et al. Gestational Trophoblastic Neoplasia, Version 2.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2019; 17(11): 1374-91.
6. Kong Y, Yang J, Jiang F, et al. Clinical characteristics and prognosis of ultra high-risk gestational trophoblastic neoplasia patients: a retrospective cohort study. Gynecol Oncol 2017; 146(1): 81-6.
7. Kong Y, Zong L, Cheng H, et al. Management and risk factors of recurrent gestational trophoblastic neoplasia: an update from 2004 to 2017. Cancer Med 2020; 9(7): 2590-9.
8. Balachandran K, Salawu A, Ghorani E, et al. When to stop human chorionic gonadotrophin (hCG) surveillance after treatment with chemotherapy for gestational trophoblastic neoplasia (GTN): A national analysis on over 4,000 patients. Gynecologic oncology 2019; 155(1): 8-12.