2025-07-15
2025 ICML口头报告|恒瑞医药“双艾”组合联合治疗NK/T细胞淋巴瘤最新研究数据公布
第18届国际恶性淋巴瘤会议(2025 ICML)于2025年近日在瑞士卢加诺举行。作为全球最大的恶性淋巴瘤国际会议之一,大会云集了全球顶级的淋巴瘤领域专家学者,分享淋巴瘤基础、临床、转化医学、新药开发等最前沿的研究成果,共同推动全球淋巴瘤诊疗事业的发展。
本次大会上,由中山大学肿瘤防治中心的李志铭教授、复旦大学附属肿瘤医院的陶荣教授和复旦大学附属眼耳鼻喉科医院的丁浩教授作为共同PI开展的一项卡瑞利珠单抗联合低剂量阿帕替尼和培门冬酶(CAPA)序贯放疗治疗初发Ⅰ/Ⅱ期NK/T细胞淋巴瘤患者的研究入选口头汇报(摘要号:063)[1],该研究曾在2023年欧洲血液学协会大会(EHA)大会上首次亮相,报告了治疗结束后的完全缓解率(CRR)和客观缓解率(ORR)[2],时隔两年,这项研究迎来了长期生存数据结果。复旦大学附属肿瘤医院刘传绪教授在卢加诺现场进行了大会报告。

2025 ICML现场图:刘传绪教授进行口头报告
01研究背景
目前国内对早期NK/T细胞淋巴瘤(IE,IIE期)以门冬酰胺化疗和放疗的有序结合形成序贯治疗模式初步显示较好的疗效,2年的总生存(OS)率达到80%[3],提高了患者长期生存率。但门冬酰胺酶副作用多,与化疗药物的联合使用增加了不良反应的发生率[4-6],部分患者不能耐受而限制了其广泛使用。因此如何改善以门冬酰胺酶为基础的治疗的安全性,从而改善患者的长期预后,仍是目前临床面临的主要课题。
卡瑞利珠单抗是一种PD-1抑制剂,阿帕替尼是血管内生长因子受体-2(VEGFR-2)高效、选择性抑制剂,卡瑞利珠单抗联合阿帕替尼的治疗方式已在多种实体瘤和淋巴瘤中显示出抗肿瘤活性和可耐受性[7-11]。本研究将PD-1抗体卡瑞利珠单抗联合低剂量阿帕替尼和培门冬酶(CAPA)序贯放射治疗,尝试用于治疗I-II期NK/TCL患者,观察其有效性和安全性。
02研究方法
该研究为一项前瞻性、多中心、单臂研究,纳入标准为:根据WHO2016标准确诊的初发NK/T细胞淋巴瘤患者,至少有1个可测量病灶,Lugano 2014分类为IE/IIE期,年龄18~80岁,ECOG PS评分为0~2分。患者共接受4个周期的治疗,以21天为周期,第1天静脉注射卡瑞利珠单抗200 mg,肌肉注射培门冬酶2000 U/m2,阿帕替尼250 mg,QD。全身治疗后,两周内给予总剂量为50~56 Gy的扩大野放疗。主要终点为放疗后(24周)的CRR。次要终点包括24周(24W) ORR、2年OS、2年无进展生存期(PFS)和安全性。

图1.研究设计
03研究结果
1临床疗效
2020年5月至2022年10月,本研究共纳入61例患者,中位年龄52岁,其中男性37例(60.7%),IIE期29例(47.5%),50例患者完成了4周期(12W)全身治疗后的疗效评估,12W CRR为70.0%,12W ORR为82.0%。53例患者在放疗后(24W)完成了疗效评估,24W CRR为88.9%(48/54),ORR为92.6%(50/54)。
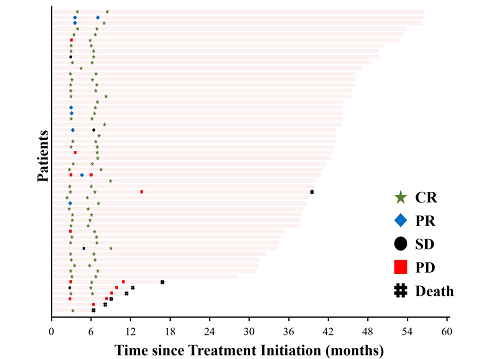
图2. 患者缓解情况
截至2025年2月,中位随访时间42.2个月(34.7-46.1),2年PFS率为83.3%(95% CI:70.4-91.0),2年OS率达到88.9%(95% CI:76.9-94.9)。
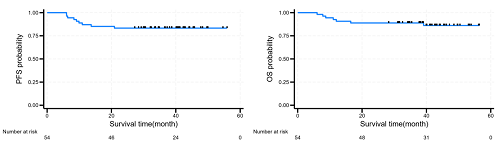
图3. PFS(左)和OS(右)的K-M曲线
12W时获得完全缓解和部分缓解(CR+PR)的患者,2年PFS率达到90.2%(95% CI:76.1-96.2),12W时疾病稳定和疾病进展(SD+PD)的患者2年PFS率为55.6%(95% CI:20.4-80.5)(P<0.05)。12W时CR+PR患者的2年OS率为95.1%(95% CI:81.9-98.8),12W时SD+PD患者2年OS率为66.7%(95% CI:28.2-87.8)(P<0.05)。
安全性方面整体可控。
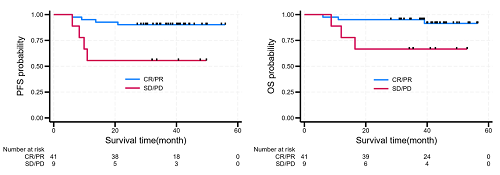
图4. 亚组分析的PFS(左)和OS(右)
04研究结论
卡瑞利珠单抗联合低剂量阿帕替尼和培门冬酶序贯放疗治疗初发I/II期NK/T细胞淋巴瘤患者具有令人鼓舞的疗效和安全性,能够大幅降低化疗带来的血液学毒性,该方案有望作为传统治疗的可行替代方案。
参考文献:
[1] Camrelizumab plus low-dose apatinib and pegaspargase followed by radiotherapy for newly diagnosed stage I/II natural killer/T-cell lymphoma: a multicenter phase II study.18-ICML Oral 063.
[2] Camrelizumab plus low-dose apatinib and pegaspargase followed by radiotherapy for newly diagnosed stage I/II natural killer/ T-cell lymphoma: a prospective multicenter single-arm study.2023 EHA P1119.
[3] Tse E, Zhao WL, Xiong J, Kwong YL. How we treat NK/T-cell lymphomas. J Hematol Oncol. 2022;15(1):74. Published 2022 Jun 3.
[4] Kwong YL, Kim WS, Lim ST, et al. SMILE for natural killer/T-cell lymphoma: analysis of safety and efficacy from the Asia Lymphoma Study Group. Blood. 2012;120(15):2973-2980.
[5] Jing XM, Zhang ZH, Wu P, et al. Efficacy and tolerance of pegaspargase, gemcitabine and oxaliplatin with sandwiched radiotherapy in the treatment of newly-diagnosed extranodal nature killer (NK)/T cell lymphoma. Leuk Res. 2016;47:26-31.
[6] Zhang L, Wang Y, Li X, et al. Radiotherapy vs sequential pegaspargase, gemcitabine, cisplatin and dexamethasone and radiotherapy in newly diagnosed early natural killer/T-cell lymphoma: A randomized, controlled, open-label, multicenter study. Int J Cancer. 2021;148(6):1470-1477.
[7] Mao, L., et al., Camrelizumab Plus Apatinib and Temozolomide as First-Line Treatment in Patients With Advanced Acral Melanoma: The CAP 03 Phase 2 Nonrandomized Clinical Trial. JAMA Oncol, 2023. 9(8): p. 1099-1107.
[8] Ding, X., et al., Camrelizumab Plus Apatinib in Patients With Recurrent or Metastatic Nasopharyngeal Carcinoma: An Open-Label, Single-Arm, Phase II Study. J Clin Oncol, 2023. 41(14): p. 2571-2582.
[9] Yu, J.H., et al., Neoadjuvant camrelizumab plus apatinib for locally advanced microsatellite instability-high or mismatch repair-deficient colorectal cancer (NEOCAP): a single-arm, open-label, phase 2 study. Lancet Oncol, 2024. 25(7): p. 843-852.
[10] Lan, C., et al., Camrelizumab Plus Apatinib in Patients With Advanced Cervical Cancer (CLAP): A Multicenter, Open-Label, Single-Arm, Phase II Trial. J Clin Oncol, 2020. 38(34): p. 4095-4106.
[11] Liu, Y., et al., Antitumor activity and safety of camrelizumab combined with apatinib in patients with relapsed or refractory peripheral T-cell lymphoma: An open-label, multicenter, phase II study. Front Immunol, 2023. 14: p. 1128172.
声明:
1.本新闻旨在分享学术前沿动态,仅供医疗卫生专业人士基于学术目的参阅,非广告用途。
2.恒瑞医药不对任何药品和/或适应症作推荐。
3.本新闻中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。医疗卫生专业人士作出的任何与治疗有关的决定应根据患者的具体情况并遵照药品说明书。